2025年9月25日(木)〜27日(土)に開催された「第84回日本癌学会学術総会」において、研究成果をポスター発表しました。内容は、ストレスホルモンであるノルエピネフリン(別名:ノルアドレナリン)とアサイゲルマニウムの 錯体形成(緩やかな結合)により、胃がん細胞株における転移のしやすさ・悪性化・抗がん剤耐性の増大を抑えることを確認した研究成果です。
タイトル: 有機ゲルマニウム化合物THGPは胃がん細胞株HGC-27 cellsにおいてノルエピネフリンによるEMTを抑制する(The organogermanium compound THGP suppresses norepinephrine-induced EMT in the gastric cancer cell line HGC-27 cells)
発表日: 2025年9月25日
会場: 金沢駅もてなしドーム地下広場
発表者: 株式会社浅井ゲルマニウム研究所 研究部 安積遵哉
1.研究の概要
アサイゲルマニウムが水に溶けた状態の化合物(THGP)は、ストレスホルモンであるノルエピネフリンと錯体形成することが報告されています。しかしながら、THGPとノルエピネフリンとの錯体形成による生理活性についてはこれまで研究されていませんでした。
ノルエピネフリンの血中濃度が高まると、がん細胞の上皮間葉転換 (EMT)が引き起こされます。EMTとは、がん細胞が動きやすい形に変わることで、悪性化や転移が起こりやすくなる現象です。本研究では、EMTに対するTHGPの作用について、ヒト胃がん細胞株HGC‑27を用いて検討しました。
その結果、THGPがノルエピネフリンと錯体形成することで、胃がん細胞株におけるEMTを抑制することが確認されました。加えて、同細胞株の抗がん剤耐性や腫瘍形成能・転移能の増大を抑えることも明らかになりました。
.png)
2.アサイゲルマニウムが水に溶けた化合物(THGP)の特徴
アサイゲルマニウムが水に溶けた状態の化合物(THGP)は、ノルエピネフリンなどの生体内物質(※)と錯体を形成することで、生体内の働きに影響を与えることが報告されています。
※隣接ジオール構造をもつ物質(ノルエピネフリン、アドレナリン、ATPなど)
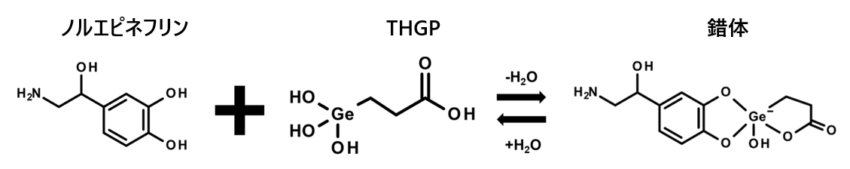
3.方法
・EMT誘導:HGC‑27細胞を、ノルエピネフリンとTHGPを含む培地で1週間培養
・評価:細胞の形態観察、免疫蛍光染色法、ウエスタンブロット、RT‑PCR、薬剤感受性、コロニー形成、細胞遊走アッセイ、細胞接着アッセイ
4.結果
1) ノルエピネフリン誘導性EMTを抑制
- ノルエピネフリンの添加により、胃がん細胞株HGC-27の形態は上皮系から間葉様の形態へ変化しました。EMTマーカー(N‑カドヘリン)の発現量も増加しました。
- THGPを併用したところ、HGC-27の形態変化が抑えられ、EMTマーカーの発現量も低下しました。
によるノルエピネフリン(NE)で誘導される形態変化の抑制.jpg)
※NC:ネガティブコントロール(陰性対照)
2) 抗がん剤に対する耐性を抑制
- HGC‑27は抗がん剤の3種すべてに感受性を示しましたが、ノルエピネフリンの添加により、感受性が低下しました。これは、抗がん剤に対する耐性が上がった(抗がん剤の効果が低下した)ことを示しています。
- THGP併用により、抗がん剤に対する耐性の増大が抑えられました。
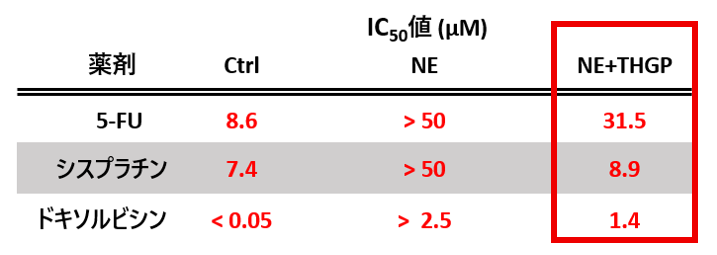
※対照(Ctrl)、ノルエピネフリン(NE)、THGP併用(NE+THGP)
3) 腫瘍形成能・転移能を抑制(in vitro)
- ノルエピネフリンの添加により、腫瘍形成能と転移能が増大しました。
- THGP併用により、腫瘍形成能と転移能の増大が抑制されました。
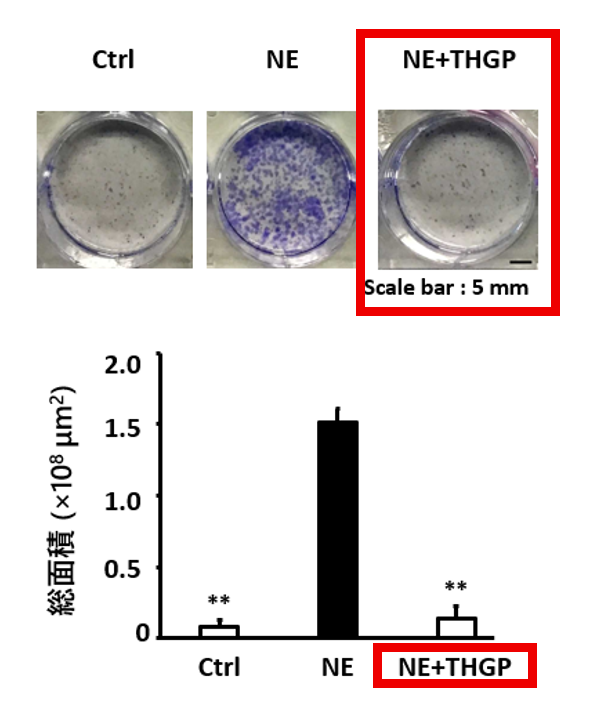
(ノルエピネフリン(NE)にTHGPを添加すると、腫瘍が形成しにくくなっている)
5.まとめ
アサイゲルマニウムが水に溶けた状態の化合物であるTHGPは、ノルエピネフリンが引き起こすEMTを抑制しました。これは、THGPとノルエピネフリンとの錯体形成によるものと考えられます。
今回の研究成果は、アサイゲルマニウムの摂取による、ストレス下のがん患者における転移の抑制、悪性化の抑制、抗がん剤効果向上の可能性を示しています。
6.補足
- 本研究は、細胞による基礎研究です。治療への応用は現時点で研究段階にあり、今後、人での有効性の検証が必要です。
- 研究の詳細については、下記の画像をクリックしてください。日本語版のPDFファイルが開きます(ダウンロード可)。英語版はこちらです。
- アサイゲルマニウムの錯体形成(相互作用)の研究データについては、こちらのページをご参照ください。
